正文共3164字,预计阅读时间约为12分钟
可点击右上角小圆点“听全文”~

间谍潜伏与反间谍行动一直是人们津津乐道的影视剧题材。在剧中,间谍会通过各种伪装打入目标机构,潜伏下来,伺机行动。而国安部门必须想方设法识破这些间谍的伪装,把威胁消灭在萌芽中。
在人体内,也会上演类似的剧情,HIV(人免疫缺陷病毒)正是一种具有“间谍”属性的病毒,有着高明的“伪装术”,而科学家们也正如影视剧中的国安人员一样,绞尽脑汁研究各种“反间谍”策略。
艾滋病为何难以治愈?
因为病毒会潜伏啊!
HIV是一种攻击人体免疫系统的病毒,主要破坏CD4+ T细胞,导致免疫功能逐渐衰退,若未治疗可发展为艾滋病(AIDS)。感染HIV后,通常经历急性感染期、潜伏期和艾滋病期,随着免疫系统的持续破坏,最终易导致机会性感染或恶性肿瘤。

HIV感染过程(1)HIV附着在CD4免疫细胞上,然后进入细胞。(2)病毒遗传物质(黄色螺旋)与CD4细胞的DNA(蓝色)相结合,接管细胞的复制系统,以复制自身。(3)新的HIV病毒颗粒离开CD4细胞,进入血液,感染更多的CD4细胞。通过这种方式,HIV病毒继续增殖,分散到体内各处。随着时间的推移,HIV病毒最终会清除CD4细胞,身体识别和抵御多种感染的能力也随之下降。(图片来源:“赛先生”公众号)
与其他大部分病毒的不同,HIV的狡猾之处在于它不仅会“袭击”,还会“潜伏”,感染机体后很快就可整合到宿主基因组,并可处于长期稳定的潜伏感染状态。
潜伏感染的意思是HIV病毒DNA整合到宿主细胞基因组,但没有游离的病毒颗粒产生,这种整合HIV基因组并潜伏感染的宿主细胞就变成了病毒储存库(也被称为“前病毒”)。研究证实,HIV感染机体后1-3天内就会建立持久的病毒储存库。潜伏感染的艾滋病毒储存库主要存在于记忆性CD4+ T细胞中,也可存在于单核巨噬细胞、星形胶质细胞以及NK细胞、CD4+CD8+ T细胞等。
目前针对艾滋病的治疗方法主要是抗逆转录病毒疗法(ART),确实可有效抑制处于活跃状态的病毒复制,甚至可把体内病毒压制到目前检测灵敏度以下的水平。然而,这种疗法对处于潜伏状态的HIV病毒储存库却几乎不能发挥作用。
那些已经“隐身”的病毒依然藏在宿主细胞里,伺机而动。一旦治疗中断或出现耐药,病毒储存库很快就被激活,复制转录产生病毒颗粒,从而导致病毒血症卷土重来。因此,潜伏感染的病毒储存库是ART疗法无法清除HIV感染的根本原因和最大障碍。
HIV 的“间谍伪装术”
在影视剧里,间谍潜伏下来需要伪造身份、获得“安全屋”、避开监控等一系列手段,而HIV 也有一整套“潜伏伪装技能”,让它能长时间隐藏在宿主细胞中而不被发现,主要有以下四种方式。
1. 瞒天过海
间谍为了成功打入目标内部,第一步往往是伪装和修改自己的身份。HIV在这方面的伪装非常巧妙。
HIV是一种具有包膜的病毒,这种包膜是在病毒从宿主细胞中释放时“顺手牵羊”而来,其表面的成分与人体细胞的外膜成分极为相似,因此看起来更像是“自己人”。借助这一伪装,很容易蒙混过关,使得HIV能够悄然与目标细胞的膜融合,成功侵入宿主免疫系统中的核心细胞——CD4+ T细胞,进行下一轮复制和感染。
HIV不仅通过“披着宿主细胞的外衣”来伪装自己,还利用特异的受体结合机制(如通过其表面的gp120蛋白与CD4分子结合),精准锁定目标细胞,将伪装和精准打击完美结合,为病毒感染铺平道路。
2. 无线电静默
在战场上,为了防止对方通过无线电侦测到自己的存在,在重大军事行动前,进攻方往往会关闭无线电联络,以避免对方发现自己的行动意图,这就是无线电静默。HIV也深谙此术。
在发生潜伏感染的CD4+ T细胞中,有许多制约HIV前病毒进行转录的因素,包括前病毒在细胞基因组定位附近缺乏转录因子或存在转录抑制因子;病毒启动子的表观遗传控制(包括组蛋白修饰的乙酰化和甲基化)。
通过调控和关闭其启动子区域,使病毒基因组长期处于“沉默状态”,不表达或极低水平表达艾滋病毒相关蛋白,因此可有效避免被免疫系统监测和消灭。由于缺乏特定的表面标记物,科学家们也难以对这些处于潜伏感染状态的静息细胞进行靶向研究。
3. 深入虎穴
为了发挥更大效果,间谍往往会尽量打入到对方内部,甚至是指挥高层。HIV就是瞄准了“最高层”,基因组是人体细胞的最高指挥官,它所携带的信息决定着细胞命运。
HIV为了达到与宿主细胞生死与共的目的,通过自身编码的整合酶将其基因组整合到宿主细胞基因组中,从而如同狗皮膏药般成为宿主细胞基因的一部分。只要这个细胞活着,病毒基因组的遗传信息就一直存在。
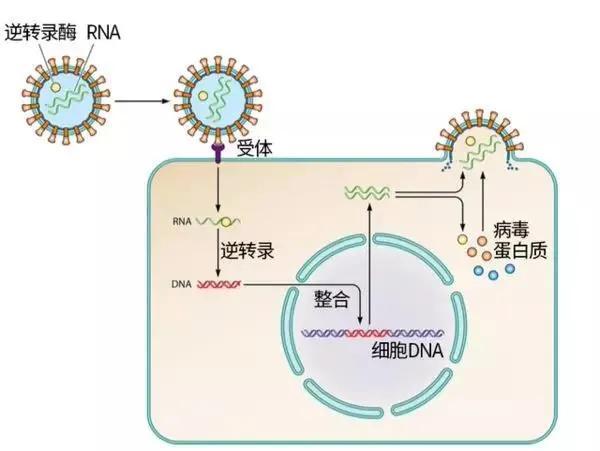
病毒基因整合进宿主基因组示意图
4. 远交近攻
优秀的间谍不仅要隐藏自己,还需扰乱对方的通信和协作。HIV通过破坏免疫系统内的“通信网络”,削弱宿主对感染的响应能力。
HIV能破坏免疫细胞间的信息交流,通过感染并摧毁CD4+ T细胞,导致免疫细胞间失去协调和指挥。HIV还能诱导免疫抑制分子(如PD-1、CTLA-4等)表达,使得免疫细胞陷入功能性“疲软”状态。此外,HIV感染初期引发强烈炎症,吸引免疫细胞到感染部位,但随后病毒利用这些活跃的免疫细胞作为新的感染目标,进一步扩散。
要想发现和清除这些潜伏在人体内的 HIV,就必须先搞清楚它的潜伏机制。找到它伪装和隐藏的关键环节,才能针对性地研发“反间谍”策略,把潜伏的病毒揪出来加以消灭。
放诱饵抓间谍
抓间谍的最有效方法是引蛇出洞再行抓捕,针对HIV的“间谍”属性,科学家设计了一种对潜伏HIV感染的“激活后再杀死”策略。
“激活后再杀死”策略正在被广泛用于艾滋病的治愈研究,其原理是通过诱饵(潜伏逆转剂,LRA)激活患者体内的潜伏病毒使之活跃复制并暴露身份,进而被机体免疫系统或抗病毒药物识别并杀死,即“引蛇出洞,再杀死病毒”。
目前,科学家们正在探索寻找不同的病毒诱饵,以更安全高效的激活HIV潜伏储存库,这些诱饵包括DNA甲基转移酶抑制剂、组蛋白去乙酰化酶抑制剂、组蛋白甲基转移酶抑制剂、蛋白激酶C激动剂、溴结构域和末端结构域(BET)蛋白抑制剂、Akt途径激活剂、STAT氨酰化抑制剂等。
笔者的团队长期从事功能治愈HIV领域的研究工作,近些年筛选获得GIBH-LRA002、PD-1抗体、As2O3等多种“诱饵”,并在体内外验证了其治疗效果。例如,PD-1抗体联合ART疗法已在猴艾滋病毒(SIV)感染模型中完成体内预防和治疗实验,As2O3联合ART疗法也已完成猕猴治疗实验并初步完成I期临床研究,数据表明其安全性良好,可有效激活和杀死病毒储存库。

图片来源:作者提供
以毒攻毒+引蛇出洞,
可能是新型艾滋病治疗策略
单纯疱疹病毒(HSV)感染人群极为普遍,临床上发现HSV与HIV共感染可一定程度激活潜伏感染的HIV,增加患者体内的病毒复制,进而促进疾病进展。
笔者团队近期意外发现,缺失某些基因的重组HSV-1对HIV潜伏感染的激活能力大幅提升。如果进一步改造这种重组HSV病毒,可能可以达到不仅可高效激活潜伏感染的HIV储存库,还可诱导强效的抗原特异性免疫反应,从而实现消灭或长期控制HIV慢性感染的目的。
进一步研究表明,该策略可在小鼠体内激发强烈的艾滋病抗原特异性体液免疫和细胞免疫应答,并可在猴艾滋病感染模型中有效减少病毒储存库和延缓ART停药侯的病毒反弹时间(相关论文已于日前发表)。这些发现表明,改造优化的重组HSV载体疫苗有望作为治疗/治愈HIV慢性感染的新策略,从而为根治艾滋病提供研究新思路。
结语
艾滋病疫情已持续40余年,但迄今既无根治性药物,也无预防性疫苗。据联合国艾滋病规划署(UNAIDS)最新数据显示,截至2023年底,全球约有3990万人感染HIV。同年,全球新增感染人数约130万,艾滋病相关疾病导致的死亡人数约为63万。我国截至2023年底报告存活的HIV感染者约129万。
为实现治愈艾滋病的梦想,科学家们正在探索不同的策略,包括包括激活后再杀死(Shock and Kill)、免疫治疗(CAR-T细胞治疗、免疫检查点阻断、治疗性疫苗)、永久沉默(Block and Lock)、干细胞移植、基因编辑等。
但是,这个病毒在与人类免疫系统长期博弈过程中,展示了一系列高超的“间谍”本领。不同于其他已知的病原体,目前尚未发现可以自愈的HIV患者。仅靠人体自身免疫系统或许无法完全清除HIV感染,只有另辟蹊径进行创新才有可能战胜这个高度进化的沉默杀手。
2024年12月1日是第37个“世界艾滋病日”,今年的宣传活动主题为“社会共治,终结艾滋,共享健康”。在全社会齐心协力的支持下,在科学家们对 HIV 潜伏机制的深刻理解基础上,我们也终将会研发出安全高效的艾滋病治愈新策略。布下天罗地网,让潜伏病毒“无处遁形”,共同迎接没有艾滋病的未来!
参考文献:
[1] Wen Z,Li P, Yuan Y,Wang C,Li M,Wang H ,Shi M,He Y,Cui M,Chen L, Sun C. Purging viral latency by a bifunctional HSV-vectored therapeutic vaccine in chronically SIV-infected macaques. elife. 2024,DOI: 10.7554/eLife.95964
[2] He Y, Wu C, Liu Z, et al. Arsenic trioxide-induced apoptosis contributes to suppression of viral reservoir in SIV-infected rhesus macaques[J]. Microbiol Spectr, 2023, 11(5):e0052523.
[3] Yang Q, Ding Y, Feng F, et al. Structure-optimized dihydropyranoindole derivative GIBH-LRA002 potentially reactivated viral latency in primary CD4+ T lymphocytes of chronic HIV-1 patients[J]. Medchemcomm, 2017, 8(9):1806-1809.
[4] 孙彩军。无疫苗,无根治药物,我们该如何对付艾滋病?《科学大院》https://mp.weixin.qq.com/s/VDj_llRwDIftAuDQ9fDdGg
[5] 孙彩军。治愈艾滋病的希望是否存在?梦想还是要有的,万一实现了呢!《科学大院》https://mp.weixin.qq.com/s/BAkayWuSSQC6fSKJBORMiw
[6] 孙彩军。艾滋病:我不”杀人”,但很多”杀手”会随我而来。《科学大院》https://mp.weixin.qq.com/s/1Z8nnqHn4od3iiOiuCoYmA
作者简介
孙彩军,中山大学教授,博士生导师。研究方向为新型疫苗和抗病毒药物,包括艾滋病疫苗及艾滋病根治药物研发。
联系方式:suncaijun@mail.sysu.edu.cn

版权说明:未经授权严禁任何形式的媒体转载和摘编,并且严禁转载至微信以外的平台!
文章首发于科学大院,仅代表作者观点,不代表科学大院立场。转载请联系cas@cnic.cn

推荐阅读
治愈艾滋病的希望是否存在?>>
我不“杀人”,但很多“杀手” 会随我而来 >>
唾液、母乳和血液:哪种更易传播病毒?>>
改变人类历史和世界格局的9种传染病 >>

推荐资源
扫码进入“科学与中国”小程序,可观看以院士科普视频为代表的优秀科普视频,第一时间获取中国科学院公众科学日、科学节等科普活动报名信息。


科学大院是中国科学院官方科普微平台,致力于最新科研成果的深度解读、社会热点事件的科学发声
主办机构:中国科学院学部工作局
运行机构:中国科学院计算机网络信息中心
技术支持:中国科普博览
转载授权、合作、投稿事宜请联系cas@cnic.cn
大院er拍了拍你:不要忘记
点亮这里的 赞 和 在看 噢~